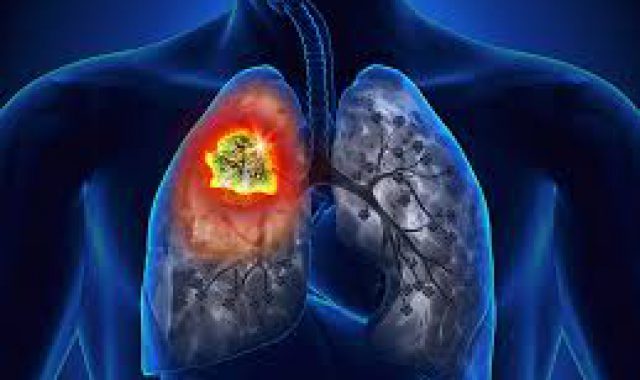
Μια νέα θεραπευτική επιλογή για την αντιμετώπιση του μη πλακώδους, μη μικροκυτταρικού καρκίνου του πνεύμονα (ΜΜΚΠ) είναι πλέον διαθέσιμη και στους ασθενείς στην Ευρώπη, μετά την πρόσφατη έγκριση της Ευρωπαϊκής Επιτροπής για χορήγηση του pembrolizumab σε συνδυασμό με καθιερωμένο σχήμα χημειοθεραπείας ως θεραπεία 1ης γραμμής. Έτσι, το pembrolizumab καθίσταται η πρώτη ανοσοθεραπεία (anti-PD1 παράγοντας) που λαμβάνει έγκριση για χορήγηση σε συνδυασμό με χημειοθεραπεία για τη θεραπεία του μεταστατικού ΜΜΚΠ.
Πιο συγκεκριμένα, η Ευρωπαϊκή Επιτροπή ενέκρινε τη χορήγηση του pembrolizumab σε συνδυασμό με πεμετρεξίδη και πλατίνη (σισπλατίνη ή καρβοπλατίνη) ως θεραπεία πρώτης γραμμής για τον μεταστατικό, μη πλακώδη ΜΜΚΠ σε ασθενείς χωρίς EGFR ή ALK θετικές μεταλλάξεις όγκου. Η έγκριση αυτή βασίστηκε στα αποτελέσματα της μελέτης φάσης ΙΙΙ, Keynote 189, τα οποία έδειξαν ανεξαρτήτως έκφρασης του βιοδείκτη PD-L1, ένα σημαντικό όφελος επιβίωσης με μείωση κατά το ήμισυ του κινδύνου θανάτου (HR=0.49 [95% CI, 0.38-0.64]; p<0.00001) και κατά 48% του κινδύνου προόδου της νόσου ή θανάτου (HR=0.52 [95% CI, 0.43-0.64]; p<0.00001) των ασθενών που έλαβαν το συνδυασμό pembrolizumab με χημειοθεραπεία σε σχέση με αυτούς που έλαβαν μόνο το καθιερωμένο σχήμα χημειοθεραπείας.
H Keynote 189 είναι μια πολυκεντρική, τυχαιοποιημένη, ελεγχόμενη με ενεργό παράγοντα, διπλά τυφλή μελέτη, κατά την οποία συνολικά 616 ασθενείς τυχαιοποιήθηκαν ώστε να λάβουν το συνδυασμό pembroliuzmab και χημειοθεραπεία ή χημειοθεραπεία μόνο. Τα πρωτεύοντα σημεία έκβασης της αποτελεσματικότητας ήταν η συνολική επιβίωση και το διάστημα ελεύθερο υποτροπής.
Στην Ευρώπη το pembrolizumab έχει εγκριθεί ως μονοθεραπεία πρώτης γραμμής για την αντιμετώπιση του μεταστατικού πλακώδους και μη πλακώδους ΜΜΚΠ σε ασθενείς με υψηλή έκφραση του βιοδείκτη PD-L1 (PD-L1 ≥50%) χωρίς EGFR ή ALK θετικές μεταλλάξεις όγκου και ως θεραπεία δεύτερης γραμμής σε ασθενείς με τοπικά προχωρημένο ή μεταστατικό ΜΜΚΠ με έκφραση του βιοδείκτη PD-L1 ≥1% που έχουν λάβει προηγουμένως τουλάχιστον ένα σχήμα χημειοθεραπείας.
Η έγκριση της Ευρωπαϊκής Επιτροπής ανοίγει το δρόμο για τη διάθεση του συνδυασμού pembrolizumab με χημειοθεραπεία με πεμετρεξίδη και πλατίνα στα 28 κράτη μέλη της ΕΕ καθώς και στις Ισλανδία, Λιχτενστάιν και Νορβηγία. Οι ασθενείς θα πρέπει να λαμβάνουν το KEYTRUDA στην εγκεκριμένη δόση των 200 mg κάθε τρεις εβδομάδες μέχρι την εξέλιξη της νόσου ή την εμφάνιση μη αποδεκτής τοξικότητας.















.jpg)








