Το Πρόγραμμα Πρώιμης Πρόσβασης σε Φάρμακα στοχεύει στη πρόσβαση ασθενών σε πολλά υποσχόμενες καινοτόμες θεραπείες πριν την Ευρωπαϊκή τους έγκριση.
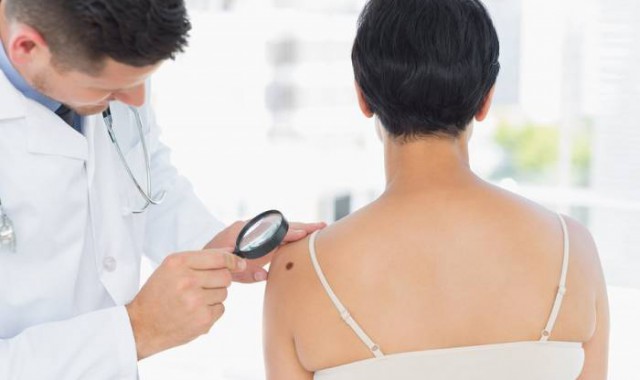
Η MSD, γνωστή και ως Merck στις ΗΠΑ και στον Καναδά, ανακοίνωσε σήμερα ότι το pembrolizumab, η anti-PD1 θεραπεία που διατίθεται ήδη στην Αμερική, γίνεται η πρώτη θεραπεία που εντάσσεται στο Πρόγραμμα Πρώιμης Πρόσβασης σε Φάρμακα (EAMS – Early Access to Medicines Scheme) της Μεγάλης Βρετανίας. Το pembrolizumab έγινε δεκτό στο Πρόγραμμα ως θεραπεία του προχωρημένου μελανώματος, με βάση τη σημαντικότητα των αποτελεσμάτων των πρώιμων ερευνών, αλλά και την απουσία άλλης σχετικής θεραπείας γι’ αυτήν την υπάρχουσα ιατρική ανάγκη. Το pembrolizumab έλαβε στο Ηνωμένο Βασίλειο στις 10 Οκτωβρίου 2014, τον προσδιορισμό του Υποσχόμενου Καινοτόμου Φαρμάκου (Promising Innovative Medicine – PIM).
Το 2014, ο Βρετανικός Οργανισμός Φαρμάκων (MHRA – Medicines and Healthcare Products Regulatory Agency), εισήγαγε το Πρόγραμμα EAMS έτσι ώστε να βοηθήσει τους ασθενείς να ωφεληθούν από πολλά υποσχόμενες καινοτόμες θεραπείες, πριν την Ευρωπαϊκή τους έγκριση. Η Ευρωπαϊκή άδεια διάθεσης του pembrolizumab για τη θεραπεία του προχωρημένου μελανώματος βρίσκεται αυτή τη στιγμή σε διαδικασία εξέτασης.
«Η MSD χαρτογράφησε το μονοπάτι για την επιτάχυνση της ανάπτυξης του pembrolizumab και συνεργάζεται με πολλές κυβερνήσεις παγκοσμίως έτσι ώστε να προσφέρει την anti-PD1 θεραπεία σε καρκινοπαθείς», δήλωσε ο Dr. Roger Perlmutter, πρόεδρος των Ερευνητικών Εργαστηρίων της MSD, για να συμπληρώσει οτι «…η εισαγωγή του pembrolizumab στο Πρόγραμμα, θα επιτρέψει σε πολλούς ασθενείς με προχωρημένο μελάνωμα στη Μεγάλη Βρετανία να έχουν πρώιμη πρόσβαση σε αυτή τη θεραπεία και υπογραμμίζει τη σημασία της δημιουργίας νέων μηχανισμών που θα φέρουν πολλά υποσχόμενες θεραπείες σε ασθενείς με περιορισμένες ή μηδενικές προοπτικές».
«Καλωσορίζουμε την στρατηγική πρόληψης που υιοθετεί η κυβέρνηση της Μεγάλης Βρετανίας στη διευκόλυνση της πρώιμης πρόσβασης σε θεραπείες για τους σοβαρά ασθενείς και χαιρόμαστε ιδιαίτερα που το pembrolizumab καθίσταται η πρώτη καινοτόμα θεραπεία που γίνεται διαθέσιμη σε ασθενείς μέσω του EAMS” δήλωσε ο Διευθύνων Σύμβουλος της MSD Μεγάλης Βρετανίας και Ιρλανδίας, κ. Mike Nally.
«Η είδηση αυτή θα γίνει δεκτή με ενθουσιασμό από την κοινότητα των ασθενών με μελάνωμα στη Μεγάλη Βρετανία. Αυτή τη στιγμή, οι προοπτικές για ασθενείς με προχωρημένο μελάνωμα είναι περιορισμένες και η πλειοψηφία των ασθενών αυτών βρίσκεται σε δύσκολη θέση, καθώς δεν μπορεί να αντέξει οιεσδήποτε καθυστερήσεις», δήλωσε η Gillian Nuttall από τον Oργανισμό Μελανώματος της Μεγάλης Βρετανίας.
Το pembrolizumab είναι μια από πρώτες θεραπείες νέας γενιάς στην ανοσο-ογκολογία που ονομάζονται anti-PD1 (προγραμματισμένος κυτταρικός θάνατος). Η αποδοχή της θεραπείας εκ μέρους του EAMS βασίστηκε στην εξέταση των στοιχείων της πεμπρολιζουμάμπης που προέκυψαν από την KEYNOTE-001, τη μεγαλύτερη κλινική μελέτη Φάσης 1β για θεραπείες anti-PD1 που διεξάγεται σε ασθενείς με προχωρημένο μελάνωμα. Πριν από αυτό, το pembrolizumab είχε προσδιοριστεί ως Πρωτοποριακή Θεραπεία από τον FDA, βάσει των ίδιων στοιχείων και είχε πάρει έγκριση για τις ΗΠΑ τον Σεπτέμβριο του 2014.
Σήμερα, πάνω από 3.500 ασθενείς σε περισσότερες από 40 χώρες έχουν αποκτήσει πρώιμη πρόσβαση στο pembrolizumab για τη θεραπεία του προχωρημένου μελανώματος, μέσω του παγκόσμιου προγράμματος διευρυμένης πρόσβασης της MSD. Ταυτόχρονα, η MSD εξελίσσει ένα ευρύ και ταχέως αυξανόμενο πρόγραμμα κλινικής ανάπτυξης του pembrolizumab, με πάνω από 70 κλινικές μελέτες, για 30 διαφορετικούς τύπους καρκίνου σε περισσότερους από 8.000 ασθενείς, τόσο ως μονοθεραπεία όσο και σε συνδυασμό με άλλες θεραπείες.
Σχετικά με το Πρόγραμμα Πρώιμης Πρόσβασης σε Φάρμακα (EAMS)
Το EAMS έχει σαν σκοπό να δώσει τη δυνατότητα σε ασθενείς ιδιαίτερα εξασθενημένους από τη νόσο τους ή με νόσους απειλητικές για τη ζωή τους, τη δυνατότητα πρόσβασης σε φάρμακα που καλύπτουν ιατρικές ανάγκες και τα οποία δεν έχουν άδεια κυκλοφορίας. Βασιζόμενος στο σχήμα διάθεσης του φαρμάκου, ο Βρετανικός Οργανισμός Φαρμάκων MHRA καλείται να διατυπώσει μια επιστημονική άποψη σχετικά με το ισοζύγιο οφέλους / κινδύνου του φαρμάκου, η οποία βασίζεται πάνω στα στοιχεία αρχικής υποβολής στο EAMS. Η πρόσβαση στο Πρόγραμμα διαρκεί για ένα έτος και μπορεί να ανανεωθεί. Το Πρόγραμμα είναι εθελοντικό και η άποψη του MHRA δεν αντικαθιστά τις νόμιμες διαδικασίες έγκρισης του φαρμάκου. Περισσότερες πληροφορίες μπορείτε να βρείτε στον ιστότοπο του MHRA https://www.gov.uk/apply-for-the-early-access-to-medicines-scheme-eams.















.jpg)








